DNA粗萃取實驗的原理為何?什麼是鹽溶與鹽析?為何DNA不溶於酒精?
非你所想-DNA粗萃取的原理與延伸探究活動
北一女中 蔡任圃
一、那些年我們一起灌輸的說法-課堂上所教授的學理
「DNA粗萃取」是高中生物課程之探討活動中,非常著名也重要的一個教學主題,這個探討活動中的各個操作步驟與其原理,不但可讓學生透過實驗操作而探究微觀世界發生的事,也常進入各大小考題。以「奇異果的DNA粗萃取」為例,探討活動中各重要步驟與原理整理如下:
(一)、果汁機打碎:可將細胞壁打碎。
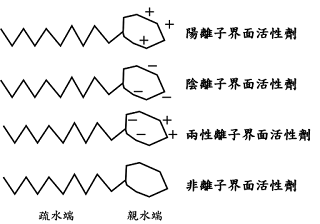
(二)、加入清潔劑:可透過清潔劑之界面活性劑(surfactant)的性質,將脂雙層的結構破壞,包含破壞細胞膜、核膜與胞器膜,使染色質釋出。
(三)、加入高濃度食鹽水:使DNA溶解於水溶液中。
(四)、加入鳳梨汁或嫩精:利用鳳梨汁或嫩精中的蛋白酶,分解溶液中的蛋白質,包含與DNA結合的蛋白質。
(五)、過濾:將其他未溶解的細胞碎片、蛋白質等雜質留在紗布上,使溶於水的DNA濾出。
(六)、加入冰酒精:由於DNA不溶於有機溶劑,加入酒精可使DNA析出;溫度越低的酒精,析出效果越佳。
上述的步驟與原理,就是在教科書與探討活動紀錄簿中常描述的教學內容,許多教材與教師會補充說明:不同濃度的食鹽水溶液中,DNA在的溶解度不同;有時也會補充一著名的微笑曲線(DNA在不同濃度之食鹽水溶液中的溶解度曲線)(圖一),並說明DNA在食鹽水濃度為0.14M時的溶解度最小。
圖一 常見於教材中的「在不同濃度的食鹽水溶液中,DNA的溶解度變化」,本文稱之為微笑曲線。
為何在不同濃度的食鹽水溶液中,DNA的溶解度會不同?常見的解釋為:DNA在水溶液中,因其磷酸根離子化而使DNA帶負電,帶負電的DNA分子彼此互斥而分散,使DNA溶於水中。NaCl濃度為0.14M時,Na+離子正好中和DNA中帶負電的磷酸根,使DNA成電中性,使DNA分子間失去互斥的作用而聚集沉澱。甚至在大考中心公告的109年試辦考試試題(109年6月15日)自然考科試題解析(連結請按我)中,說明濃食鹽水的Cl-可與染色質中帶正電的組蛋白結合,引發組蛋白與DNA分離,分離出的DNA因磷酸基而帶負電,使DNA分子之間相斥而分離,造成DNA溶於水溶液中的現象。
二、矛盾與不合理-教材中有哪些原理聽起來怪怪的?
上述所描述的原理看似很合理,但仔細思考或是經學生挑戰後,卻發現含有許多不合理之處,以下列舉幾點,這些疑難雜症將於後文說明其學理機制。
(一)、為何DNA較容易溶解於高濃度食鹽水?
許多教材資料中描述食鹽水濃度與DNA溶解度的關係,也常用「鹽溶」與「鹽析」等名詞來解釋,但對於「鹽溶」與「鹽析」皆沒有解釋清楚,讓人一頭霧水,前文的解釋也有不合理之處。
若Na+離子可與DNA作用而中和帶負電的DNA,為何NaCl濃度在0.14M時的效果最好?若將此反應表示如反應式一,依據勒沙特列原理(Le
Chatelier principle),Na+離子濃度越高,應會有更多的DNA析出。
Na+ + DNA- ⇄ Na-DNA(析出)……………………………………………………反應式一
此外,若帶負電的DNA原與帶正電的組蛋白結合,則已是電中性的狀態,應已沉澱析出,不需要外加NaCl。且在NaCl存在的情形下,Cl-與組蛋白結合後,應也會產生Na+與DNA結合而析出的情形。若此情形會發生,依據勒沙特列原理,也應該會有NaCl濃度越高DNA沉澱析出的量越高的情形。
學理解碼:什麼是勒沙特列原理? 許多化學反應為雙向反應,其化學平衡時屬於動態平衡。如果改變影響平衡的任一因素,平衡就向能夠減弱這種改變的方向移動,以抗衡該改變,這個現象被稱為勒沙特列原理或呂·查德里原理(Le
Chatelier principle)。用以下雙向反應為例: A + B A + B → C + D反應為放能反應,而C + D → A + B反應為吸能反應,若C或D的濃度下降,或是溫度下降(能量減少),皆會偏好A + B → C + D的反應方向(對抗C或D的濃度下降,或是能量減少),直到達到新的動態平衡;相反地,若C或D的濃度增加,或是溫度上升(能量增加),則會偏好C + D → A + B的反應方向(對抗C或D的濃度增加,或是能量增加)。利用勒沙特列原理,可幫助我們在一平衡反應中,判斷在特定條件下反應的進行方向。(引用自:蔡任圃,2019。生物學學理解碼。紅樹林。)
(二)、為何需要加入鳳梨汁或嫩精?
鳳梨汁或嫩精富含蛋白酶,嫩精的原料常是木瓜;事實上,奇異果、鳳梨與木瓜皆是富含蛋白酶的水果,既然實驗材料為奇異果,本身已富含蛋白酶,何需另外添加?
(三)、為何DNA不溶於有機溶劑?這句話是什麼意思?
「DNA不溶於有機溶劑」這句話要如何解釋?什麼是「溶解」?酒精與水可以互溶,DNA與水也可互溶,為何DNA卻難溶於酒精?
三、食鹽水的角色-食鹽水的濃度變化如何造成鹽溶或鹽析?
鹽溶與鹽析是較偏向化學或生物化學的學理內容,在新課綱強調跨科的理念下,若生物老師也能熟悉相關概念,有助於對許多生物現象的瞭解與解釋。生化領域在討論鹽溶與鹽析時,大多是在討論蛋白質而非DNA,故以鹽溶與鹽析說明DNA粗萃取的原理時,須小心不要誤用。
(一)、鹽溶是什麼意思?
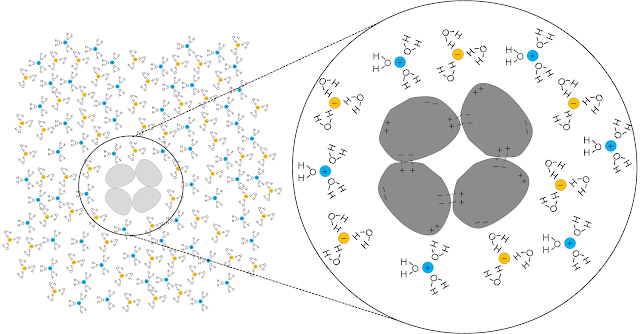
在溶液中離子的溶度較低時,也就是離子強度(Ionic strength)較低時,此時若溶液的離子強度逐漸增加,可增加某些溶質的溶解度,這個現象稱為鹽溶(salting in)。蛋白質屬於大分子,分子內各區域會因胺基酸的組成,可能會帶正電或帶負電,造成蛋白質分子內部分區域為正電、部分區域為負電的現象,蛋白質分子之間的不同區域會因正、負電互相吸引,使蛋白質分子互相凝聚而析出(圖二左側)。
學理解碼:什麼是離子強度? 離子化合物溶於水後會解離形成離子,溶液中的總離子濃度會影響不同鹽類的溶解度,而離子強度就是作為溶液中總離子濃度的指標,是由溶液中所有離子的濃度所決定,也是離子溶液的重要特徵之一,其單位可以用體積莫爾濃度(molar)或重量莫爾濃度(molal) ,其函數如下: I:離子強度;Ci:離子i的濃度;Zi:離子i的電荷數(例如Na+為+1)
當溶液的離子強度逐間增加,帶正電與負電的離子可各自與蛋白質分子中負電與正電的區域吸引、結合,結果蛋白質表面的正、負電被離子屏蔽而被中和,蛋白質分子之間失去吸引力而散開,增加了與水分子作用的面積而溶於水(圖二右側)。所謂的某物質溶於水,常是由某物質分子與水分子產生作用力(例如:形成氫鍵)而產生的巨觀現象。
圖二 蛋白質發生鹽溶的機制。
由上述機制可知,蛋白質表面的電荷與電荷分布情形會影響蛋白質的溶解度,這也可解釋當改變溶液的酸鹼值,進而改變蛋白質的電荷時,當在特定酸鹼值可讓某種蛋白質呈現淨電荷中性(此酸鹼值稱為該蛋白質的等電點),此時蛋白質雖然總電荷為0,但因部分區域帶正電、部分區域帶負電,引發蛋白質分子之間互相吸引而沉澱析出,這就是造成蛋白質於等電點時,溶解度最低的原因。另一方面,當蛋白質遠離等電點時,蛋白質會有總電荷為正電或負電的情形,此時蛋白質易因互相電荷排斥而分散,使溶解度增加。當同時考慮蛋白質溶液的鹽溶現象與酸鹼值時,就可發現在遠離等電點時,鹽溶的效果更佳。
(二)、鹽析是什麼意思?
離子與非離子溶質在水溶液中會與溶劑(水)產生作用力而溶於水,若溶液中離子強度較高時,離子與溶劑(水)產生作用的程度增加,離子與非離子之間即會競爭與水的作用,當離子強度越來越高,水分子大多與離子作用,此時非離子溶質因無法與水作用而凝集析出,這個現象稱為鹽析(salting out)。以蛋白質為例,當溶液中的鹽類濃度很高時,鹽類會與蛋白質競爭與水的作用,當大部分的水與鹽類作用時,蛋白質就無法與水作用,此時透過蛋白質分子疏水區域的作用力,迫使蛋白質之間產生作用而沉澱析出(圖三),像這樣非極性分子間或非極性區域間的作用力稱為倫敦分散力(London dispersion force)。
(a)
圖三 蛋白質發生鹽析的機制。
(a)離子強度不高時,溶液中的蛋白質(灰色橢圓狀)與水分子作用而溶於水。
(b)離子強度很高時,溶液中的離子與水分子作用,使蛋白質(灰色橢圓狀)無法與水作用而凝集析出。
學理解碼:什麼是倫敦分散力? 早期科學家認為非極性分子的分子之間不具有作用力,但卻觀察到在高壓、低溫的環境中,非極性分子也能從氣態轉變成液態,或由液態轉變成固態,這代表非極性分子之間也具有作用力,這個作用力就是「倫敦分散力」。非極性分子雖然不具極性,但在任何的瞬間,可因電子於瞬間產生不均勻分布,而出現瞬間偶極矩(或稱為「瞬間極化」),使得相鄰的非極性分子經感應形成電荷相反的瞬間偶極矩,這兩分子之間即可產生正負相吸的作用力,稱為分散力(dispersion force),此作用力是由德裔美國物理學家弗里茲‧倫敦(Fritz London, 1900-1954)所提出,因此又稱為倫敦分散力。 以下圖為例,若兩非極性分子距離遠(A),兩分子間幾乎沒有作用;若兩非極性分子靠近(B),當任一分子瞬間出現電子分佈不均勻而出現部分正電端(δ+)與部分負電端(δ-),相鄰的非極性分子會感應出相對應的電荷分佈,使得兩分子因正負相吸而產生作用力,此作用力產生的機制,即為文中脂肪酸之間所產生作用力的原因,且距離越靠近作用力越大。
(三)、0.14M食鹽水的說法從何而來?
探討蛋白質的鹽溶與鹽析現象時,硫酸銨是常使用的鹽類。圖四為理論上蛋白質在不同濃度的硫酸銨溶液中,其溶解度的變化情形,此曲線與前文所述的DNA微笑曲線的上下起伏趨勢正好相反。換句話說,用鹽溶或鹽析的角度是無法解釋微笑曲線的現象。那微笑曲線與DNA在0.14M食鹽水中溶解度最低的說法是怎麼來的?
DNA在0.14M食鹽水中溶解度最低的說法,應是承襲自國編版時代的DNA粗萃取實驗,那個年代是以雞血作為材料,純化產物的步驟與原理大致如下:
1.取新鮮雞血約180毫升(鳥類的紅血球具有細胞核),邊攪拌邊加入100毫升10%檸檬酸鈉(防止凝血)
2.於冰箱中靜置24小時或是用離心機離心,使血球沉澱,取下層血球液進行後續萃取步驟
3.取5-10毫升雞血,邊攪拌邊加入20毫升蒸餾水(使血球破裂)
4.以紗布過濾後,加入40毫升2 M食鹽溶液
5.緩慢地加入蒸餾水,使絲狀物逐漸析出,直到絲狀物不再增加(約需300毫升的蒸餾水)
6.以玻棒捲起絲狀物,放入另一20毫升2 M食鹽溶液,攪拌後使絲狀物溶解
7.繼續邊攪拌邊放入絲狀物,直到絲狀物不再溶解
8.加入冷卻的95%冰凍酒精(約50毫升),可析出較清潔的絲狀物
9.以玻棒捲起絲狀物。此絲狀物即為雞血球的DNA
其中步驟4至6的原理,為絲狀物在不同濃度的食鹽溶液中的溶解度不同,依教科書的說明,絲狀物即為雞血球的DNA,師生自然就會解釋成:DNA在較低濃度的食鹽溶液中溶解度較低。但那個絲狀物就是DNA嗎?
筆者目前追到最早的文獻,是Mirsky與Pollister在1942發表的論文,論文中描述在純化核蛋白(nucleoprotein)時,可利用其在不同食鹽水濃度中具不同溶解度的特性。核蛋白可溶於1 M的食鹽水,但不溶於0.14 M,若食鹽水的濃度繼續下降至0.02 M時,核蛋白又可溶解了(Mirsky and Pollister, 1942),該文獻中此段文字並無引註資料來源,可能是Mirsky與Pollister原創的觀察與結論。透過這個特性,可利用核蛋白在0.14 M食鹽水析出,再經離心沉澱後取出,再回溶於1 M食鹽水,再逐漸加水稀釋使食鹽水濃度下降至0.14 M,核蛋白又再度析出;透過重複操作上述步驟,可萃取出純度較高的核蛋白(Mirsky and Pollister, 1942、Griffin and Nye, 1948)。這裡所稱的核蛋白是指DNA與蛋白質的混合物,後來的論文稱之為去氧核糖核蛋白(deoxyribonucleoprotein, DNP)。
早期科學家為了從生物組織中萃取出核酸進行研究,嘗試了許多萃取方法,科學家發現DNP與核糖核蛋白(ribonucleoprotein, RNP)在不同食鹽水濃度中的溶解度不同,其中DNP在0.14 M的食鹽水中的溶解度最低,但在此濃度下,RNP的溶解度仍高,故可利用此濃度將DNP與RNP分離(Davies and Walker, 1974、李等人,2002),或是藉此萃取RNP以進行RNA的相關研究(Kerr and Seraidarian, 1949)。
需特別注意,DNP是DNA與和DNA結合的蛋白質(主要為組蛋白),一同形成的混和物,並不是指DNA單一物質;RNP則是指RNA與和RNA結合的蛋白質,也不是RNA單一物質;故在0.14 M食鹽水中溶解度最低的物質,並不是DNA分子,而是DNA與蛋白質的混和物。例如Itzhaki(1967)從大鼠胸腺萃取DNP的過程中,以不同濃度的食鹽水測試,發現DNP在0.1 mM的食鹽水中開始沉澱,並在約0.14 M時達到最大值,但實驗結果的圖形中(圖五),縱軸卻以「soluble fraction (% of total DNA)/可溶性比例(佔總DNA的百分比)」表示,也許因此造成部分讀者以為此圖是指DNA的溶解度變化。
前文所介紹知雞血DNA粗萃取實驗的步驟中,並無加入蛋白酶,因此析出的絲狀物應為DNP,因此有類似的溶解度特性,但並非是DNA。
圖五 取自大鼠胸腺的DNP在不同食鹽水中的溶解度(取自:Itzhaki, 1967)。
(四)、加入食鹽水到底是為了什麼?
筆者曾將奇異果DNA粗萃取實驗中所獲得的DNA樣本,分別放入0 M、0.14 M、5 M的食鹽水溶液,結果發現這些溶液皆可以溶解DNA樣本(圖六),這證明了DNA樣本在水溶液中皆可溶解,並無在0.14 M食鹽水中可沉澱析出的現象,雖然這個定性的實驗並無測量DNA樣本在不同濃度食鹽水的溶解度,其結論不一定可靠,但可以作為延伸探究的主題,讓學生探究粗萃取而得之DNA樣本的相關性質。無論如何,還是建議未來在教授相關課程與探討活動時,不須描述食鹽水濃度影響DNA溶解度,與微笑曲線等說法,不然就要說明DNP與DNA的不同。
圖六 DNA樣本分別放入0 M、0.14 M、5 M的食鹽水溶液,結果發現這些溶液皆可以溶解DNA樣本。
加入食鹽水可提供溶液中的正電荷離子(Na+),在加入酒精使DNA析出的反應中扮演重要角色(請見下文)。高濃度食鹽水所造成的鹽析現象亦可能發揮作用,但對象不是DNA而是蛋白質,高濃度食鹽水可讓蛋白質析出沉澱(圖四),可藉此過濾掉蛋白質(Miller, et al., 1988)。此外,曾有學者提出利用高濃度的食鹽水來萃取植物組織的核酸,可有效地將核酸與多醣類分離,這是因為高濃度的食鹽水可使多醣類析出(Rezadoost, et al., 2016)。從植物組織萃取核酸的操作中,多醣類的污染一直是棘手問題。
四、需要加鳳梨汁嗎?
筆者也曾嘗試將奇異果以果汁機打碎後,分別不過濾與以紗布過濾後,直接加入冰酒精,也就是未加入清潔劑、濃食鹽水、鳳梨汁等,結果如圖七,結果皆有大量的DNA粗萃取產物。以上實驗暗示著:實驗操作步驟中,加入清潔劑、濃食鹽水與鳳梨汁等步驟,可能沒有實際的作用與效益,這些步驟背後的原理,如:破壞脂雙層、分解蛋白質、有助於DNA溶解等,可能僅是"想像”。
圖七 正規操作方式、過濾後直接加冰酒精與不過濾直接加冰酒精,三種處理對DNA粗萃取產物的影響。
若將DNA粗萃取實驗中所取出的DNA樣本,放入95%的酒精,會發生什麼事?結果是DNA樣本不會溶於95%的酒精(圖八)。
圖八 將DNA樣本放入95%的酒精,DNA樣本不會溶解。
為何DNA不會溶於酒精等有機溶劑呢?事實上,以酒精使DNA析出的原理,與鹽析是類似的。依前文所述,所謂的溶於水,是該分子與水分子產生作用力(例如:形成氫鍵等作用力)後所產生的巨觀現象。DNA與水皆為極性較大的分子,因此在水溶液中DNA很容易與水分子產生作用而溶於水,但若溶液中加入極性較低的酒精,DNA較無法與酒精分子產生作用,在水分子極少的情形下,DNA被迫與溶液中的正電荷離子(例如:Na+)產生作用,DNA即形成鈉鹽而發生凝集沉澱。鹽析的原理,是非離子溶質與離子在競爭與溶劑的作用,在酒精析出DNA的過程中,是將溶劑改為極性較低的酒精,使得極性較高的DNA與Na+結合(圖九)。由此可知,加入酒精使DNA析出,需在溶液中有Na+或其他正電荷離子才會發生,這是「DNA粗萃取」的操作步驟中需要加入食鹽水(提供Na+)的原因之一;但即使操作步驟中未加入食鹽水,直接加入酒精依然可讓DNA析出(圖七),代表奇異果汁已有足夠的Na+或其他正電荷離子。
(a)
(b)
圖九 酒精使DNA析出的原理。
(a)在水溶液中,DNA溶於水的情形。
(b)加入大量酒精後,迫使DNA與Na+結合而析出。
六、科學家是如何萃取DNA的?
科學家在實驗室萃取DNA的方法有很多種,利用化學試劑使DNA析出的方法,大致上包含以下步驟:
(一)、在緩衝液中,利用物理方法使細胞破碎(透過研磨或超音波破壞細胞結構)
(二)、加入界面活性劑破壞脂雙層結構
(三)、加入蛋白酶、酚(Phenol)或氯仿(Chloroform)等,去除蛋白質(包含組蛋白);有時也會加入RNA酶,以去除RNA
(四)、加入鹽類(如醋酸鈉)後再加入乙醇或異丙醇,使DNA析出沉澱
步驟三所加入的蛋白酶,常見的為蛋白酶 K (Proteinase
K)。蛋白酶 K是在1974年於白色側齒黴菌(Engyodontium
album)中發現的,蛋白酶K可以將一般蛋白質分解去除,也可迅速使核酸酶失去活性,以避免DNA和RNA的降解,是萃取核酸時常用的試劑之一。酚與氯仿可使蛋白質變性而與DNA分離,蛋白質可溶於氯仿但DNA不溶於氯仿等有機溶劑,如此可使DNA與蛋白質分離。
步驟四所加入的鹽類(如醋酸鈉)可提供Na+,再加入乙醇或異丙醇時可使DNA與Na+結合而析出(原理請見上文)。
七、粗萃取DNA所取得的DNA樣本,真的是DNA嗎?
Miller等人於1988年發表了只利用飽和食鹽水與酒精等,而不使用可能傷害細胞且對環境有毒的有機溶劑(例如:酚或氯仿等)的方法,來萃取血球的DNA。他們的方法與探討活動所使用的方法相似,可供比對與參考。Miller等人將血球細胞加入含抗凝血劑的低張緩衝溶液與蛋白酶K溶液使血球破裂後與分解蛋白質,隔夜後加入飽和食鹽水(約為6M的NaCl溶液),使蛋白質析出沉澱(蛋白質的鹽析現象),最後加入室溫的無水酒精使DNA析出,取出DNA樣本放入緩衝液保存。
用這個方法所萃取得到的DNA樣本,其產量與使用酚、氯仿的萃取方法相當,且OD260/280的比值為1.8~2.0,代表去除蛋白質的效果很好,DNA的純度夠高(Miller, et al., 1988)。參考此篇論文的結論,探討活動所粗萃取而得的DNA樣本,應是純度夠高的DNA。
學理解碼:什麼是OD260/280? OD代表光密度(optical density),用來表示「待測物吸收的光密度」。一般而言,核酸最大吸收光的波長為260 nm,蛋白質及酚類物質的最大吸收光的波長為280 nm,利用在兩個波長,測量的待測物所吸收的光密度(OD260與OD280),再求其商值(OD260/280),可用來檢測待測物的成分。在溶液pH 7至8.5時,DNA的OD260/280理想比值為1.7~1.9,RNA為1.8~2.0。若OD260/280較低時,代表含有蛋白質或酚類等物質。
八、帶著學生來玩DNA-DNA粗萃取的延伸探究
(一)、粗萃取DNA的各步驟中哪一項最重要?
表一 利用奇異果進行DNA粗萃取,比較各類操作過程的DNA粗萃取效果
(○:代表須執行該項步驟;X:代表省略該項步驟)。
|
操作步驟 |
第1類 (正規步驟) |
第2類 |
第3類 |
第4類 |
第5類 |
|
1.果汁機打碎 |
○ |
○ |
○ |
○ |
○ |
|
2.加入清潔劑 |
○ |
X |
○ |
○ |
○ |
|
3.加入高濃度食鹽水 |
○ |
○ |
X |
○ |
○ |
|
4.加入鳳梨汁或嫩精 |
○ |
○ |
○ |
X |
○ |
|
5.過濾 |
○ |
○ |
○ |
○ |
X |
|
6.加入冰酒精 |
○ |
○ |
○ |
○ |
○ |
|
DNA的粗萃取效果 |
|
|
|
|
|
(二)、不同濃度的食鹽水會影響DNA樣本的溶解度嗎?
將探討活動中依正規的DNA粗萃取方式,將所析出的DNA樣本撈出收集起來備用。分別配置0 M、0.14 M、5 M的食鹽水,各取2毫升分別放入3個的小培養皿中,一次將一個小培養皿放置於電子秤上,將重量歸零。一次放入一點DNA樣本於小培養皿的食鹽水溶液中,並經將攪拌後觀察溶解情形,直到DNA樣本出現攪拌後仍無法全部溶解時,紀錄電子秤所測量的質量,代表所加入的DNA樣本質量。三個濃度的食鹽水溶液皆進行以上的步驟,將所測量的數據紀錄於表二,最後比較0 M、0.14 M、5 M的食鹽水對DNA樣本的溶解度。
表二 DNA樣本在不同濃度的2毫升食鹽水中的溶解度比較。
|
食鹽水濃度 |
0 M |
0.14 M |
5 M |
|
可溶解的DNA樣本質量 |
|
|
|
八、參考資料
Burgess, R. R. 2009. Protein precipitation techniques.
Methods Enzymol. 463: 331-42.
Davies, K. E. and Walker, I.
O. 1974. The solubility of calf thymus chromatin in
sodium chloride. Nucleic. Acids Res. 1(1):
129–139.
DNA_extraction (2020, August 4). In Wikipedia,
the free encyclopedia. Retrieved August 12, 2020,
from https://en.wikipedia.org/wiki/DNA_extraction
Doyle, J. J. and Doyle, J. L. 1987. A rapid DNA isolation procedure
for small quantities of fresh leaf tissue. Phytochem. Bull. 19: 11–15.
Griffin, A. C. and Nye, W. N. 1948. Tissue proteins and
carcinogenesis; the effect of carcinogenic azo dyes on liver proteins. J.
Biol. Chem. 176(3):
1225-1235.
Itzhaki, R. F. 1967. Structure and properties of
rat thymus deoxyribonucleoprotein. Solubility properties and effects of
precipitation. Biochem. J. 105(2):
741-748.
Kerr, S. E. and
Seraidarian, K. 1949. Studies on ribonucleic acid. I. preparation from
pancreas. J. Biol. Chem. 180(3):
1203–1208.
Lindh, N. O. and Brantmark, B. L. 2009.
Preparation and analysis of basic proteins. In: Methods of Biochemical
Analysis. volume 110 (ED. by Glick, D). John Wiley & Sons.
Miller, S. A., Dykes, D. D. and Polesky, H. F.
1988. A simple salting out procedure for extracting DNA from human nucleated
cells. Nucleic Acids Res. 16(3):
1215.
Mirsky, A.
E. and Pollister, A. W. 1942. Nucleoproteins of cell nuclei. Proc. Natl. Acad. Sci. USA. 28: 344-352.
Oth, A. and Desreux, V.
1957. Solubilité et dissociation d'une désoxyribonucléoprotéine. J. Polym.
Sci. 23(104): 716.
Rezadoost, M. H., Kordrostami,
M. and Kumleh, H. H. 2016. An efficient protocol
for isolation of inhibitor-free nucleic acids even from recalcitrant
plants. 3 Biotech. 6(1): 61.
Salting_in(2019, September 29). In Wikipedia, the free encyclopedia. Retrieved August
12, 2020, from https://en.wikipedia.org/wiki/Salting_in
Salting_out (2020, August 10). In Wikipedia,
the free encyclopedia. Retrieved August 12, 2020,
from https://en.wikipedia.org/wiki/Salting_out
李建武、蕭能庚、余瑞元、陳麗蓉、陳雅蕙、陳來同、袁明秀,2002。生物化學實驗原理和方法。藝軒圖書出版社。台北市。
蛋白酶K(2020, July 30). In Wikipedia, the
free encyclopedia. Retrieved August 12, 2020, from https://zh.wikipedia.org/wiki/蛋白酶K














牛b阿老鐵 解決我的問題了��
回覆刪除